การจัดจำแนกสาร
- สารเนื้อผสม ( Heterogeneous Substance ) หมายถึง สารที่มีเนื้อสารแตกต่างกันในแต่ละส่วน จะทำให้สารนั้นมีสมบัติ ไม่เหมือนกันตลอดทุกส่วน เช่น น้ำอบไทย , น้ำคลอง ฯลฯ
3. การละลายน้ำเป็นเกณฑ์ จะจำแนกได้ออกเป็น 3 กลุ่ม คือ
- สารที่ละลายน้ำได้ เช่น เกลือแกง ( NaCl ) , ด่างทับทิม ( KMnO4 ) ฯลฯ
- สารที่ละลายน้ำได้บ้าง เช่น ก๊าซคลอรีน ( Cl2 ) , ก๊าซคาร์บอนไดออกไซด์ ( CO2 ) ฯลฯ
- สารที่ไม่สามารถละลายน้ำได้ เช่น กำมะถัน ( S8 ) , เหล็ก ( Fe ) ฯลฯ
- สารที่ละลายน้ำได้ เช่น เกลือแกง ( NaCl ) , ด่างทับทิม ( KMnO4 ) ฯลฯ
- สารที่ละลายน้ำได้บ้าง เช่น ก๊าซคลอรีน ( Cl2 ) , ก๊าซคาร์บอนไดออกไซด์ ( CO2 ) ฯลฯ
- สารที่ไม่สามารถละลายน้ำได้ เช่น กำมะถัน ( S8 ) , เหล็ก ( Fe ) ฯลฯ
4. การนำไฟฟ้าเป็นเกณฑ์ จะจำแนกได้ออกเป็น 2 กลุ่ม ได้แก่
- สารที่นำไฟฟ้าได้ เช่น ทองแดง ( Cu ) , น้ำเกลือ ฯลฯ
- สารที่ไม่นำไฟฟ้า เช่น หินปูน ( CaCO3 ) , ก๊าซออกซิเจน ( O2 )
แต่โดยส่วนใหญ่นักเคมี จะแบ่งสารตามลักษณะเนื้อสารเป็นเกณฑ์ ดังนี้
- สารที่นำไฟฟ้าได้ เช่น ทองแดง ( Cu ) , น้ำเกลือ ฯลฯ
- สารที่ไม่นำไฟฟ้า เช่น หินปูน ( CaCO3 ) , ก๊าซออกซิเจน ( O2 )
แต่โดยส่วนใหญ่นักเคมี จะแบ่งสารตามลักษณะเนื้อสารเป็นเกณฑ์ ดังนี้
สารบริสุทธิ์ ( Pure Substance ) คือ สารเนื้อเดียวที่มีจุดเดือด และ จุดหลอมเหลวคงที่
ธาตุ ( Element ) คือ สารบริสุทธิ์ที่ประกอบด้วยอะตอมเพียงชนิดเดียวกัน เช่น คาร์บอน ( C ) , กำมะถัน ( S8 )
สารประกอบ ( Compound Substance ) เกิดจากธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมกัน โดยมีอัตราส่วนในการร่วมกันคงที่แน่นอนได้แก่ กรดน้ำส้ม ( CH3COOH ) , กรดไฮโดรคลอริก ( HCl ) ฯลฯ
ของผสม ( Mixture ) หมายถึง สารที่เกิดจากการนำสารตั้งแต่ 2 ชนิดขึ้นไปมาผสมกันโดยไม่จำกัดส่วนผสม และ ในการผสมกัน
นั้นไม่มีปฏิกิริยาเกิดขึ้นระหว่างสารองค์ประกอบที่นำมาผสมกัน ซึ่งมี 3 ประเภท ได้แก่
นั้นไม่มีปฏิกิริยาเกิดขึ้นระหว่างสารองค์ประกอบที่นำมาผสมกัน ซึ่งมี 3 ประเภท ได้แก่
1. สารละลาย ( Solution Substance ) เป็นสารเนื้อเดียวที่มีสัดส่วนในการรวมกันของธาตุ หรือ สารประกอบไม่คงที่ไม่สามารถเขียนสูตรได้อย่างแน่นอน และ มีขนาดอนุภาคที่เล็กกว่า 10-7 เซนติเมตร ซึ่งมี 3 สถานะ เช่น อากาศ , น้ำอัดลม , นาก , และ โลหะผสม ทุกชนิด ฯลฯ ซึ่งสารละลายจะแบ่งออกเป็น 2 ส่วน ได้แก่ ตัวทำละลาย ( Solvent ) และ ตัวถูกละลาย ( Solute ) จะมีข้อสังเกต ดังนี้
- สารใดที่มีปริมาณมากจะเป็นตัวทำละลาย และ สารใดมีปริมาณน้อยจะเป็นตัวถูกละลาย เช่น
แอลกอฮอล์ฆ่าเชื้อ มีเอทานอล 70 % และ น้ำ ( H2O ) 30 % หมายความว่า น้ำจะเป็นตัวถูกละลาย และ เอทานอลเป็นสารละลาย เพราะแอลกอฮอล์มีปริมาณตามเปอร์เซนต์ที่มากกว่าน้ำ
- สารใดที่มีสถานะเช่นเดียวกับสารละลายเป็นตัวทำละลาย เช่น
น้ำเชื่อม ซึ่งน้ำเชื่อมจัดอยู่ในสภาพที่เป็นของเหลว ( Liquid ) ดังนั้นจึงสรุปได้ว่า น้ำเป็นตัวทำละลาย และ น้ำตาลทราย ( C12H22O11 ) เป็นตัวถูกละลาย
- สารใดที่มีปริมาณมากจะเป็นตัวทำละลาย และ สารใดมีปริมาณน้อยจะเป็นตัวถูกละลาย เช่น
แอลกอฮอล์ฆ่าเชื้อ มีเอทานอล 70 % และ น้ำ ( H2O ) 30 % หมายความว่า น้ำจะเป็นตัวถูกละลาย และ เอทานอลเป็นสารละลาย เพราะแอลกอฮอล์มีปริมาณตามเปอร์เซนต์ที่มากกว่าน้ำ
- สารใดที่มีสถานะเช่นเดียวกับสารละลายเป็นตัวทำละลาย เช่น
น้ำเชื่อม ซึ่งน้ำเชื่อมจัดอยู่ในสภาพที่เป็นของเหลว ( Liquid ) ดังนั้นจึงสรุปได้ว่า น้ำเป็นตัวทำละลาย และ น้ำตาลทราย ( C12H22O11 ) เป็นตัวถูกละลาย
2. สารแขวนลอย ( Suspension Substance ) คือ สารที่เกิดจากอนุภาคขนาดเส้นผ่าศูนย์กลางที่มากกว่า 10-4 เซนติเมตร ซึ่งจะลอยกระจายอยู่ในตัวกลางโดยอนุภาคที่มีอยู่ในของผสมนั้นมีขนาดใหญ่ จึงสามารถมองเห็นอนุภาคในของผสมได้อย่างชัดเจน เมื่อตั้งทิ้งไว้ อนุภาคจะตกตะกอนลงมา ซึ่งสารแขวนลอยนั้นจะไม่สามารถผ่านได้ทั้งกระดาษกรอง และ กระดาษเซลโลเฟน เช่น โคลน , น้ำอบไทย
3. คอลลอยด์ ( Colliod ) จะประกอบด้วยอนุภาคขนาดเส้นผ่าศูนย์กลางระหว่าง 10-4 และ 10-7 เซนติเมตร ซึ่งจะไม่มีการตกตะกอน สามารถกระเจิงแสงได้ ซึ่งเรียกปรากฏการณ์นี้ว่า " ปรากฏการณ์ทินดอลล์ " และ ภายในอนุภาคก็มีการเคลื่อนที่แบบบราวน์เนียน( Brownian Movement ) กล่าวคือ เป็นการเคลื่อนที่ที่ไม่แน่นอน ในแนวเส้นตรง ซึ่งจะสามารถส่องดูได้จากเครื่องที่เรียกว่า " อัลตราไมโครสโคป " ( Ultramicroscope ) ซึ่งคอลลอยด์จะสามารถผ่านกระดาษกรองได้ แต่ไม่สามารถผ่านกระดาษเซลโลเฟนได้ เช่น กาว , นมสด
คอลลอยด์ในชีวิตประจำวัน
คอลลอยด์มีหลายชนิด ดังนี้
การทดสอบความบริสุทธิ์ของสาร
มี 3 ประเภท ได้แก่
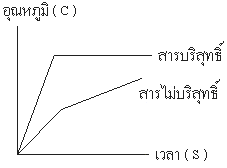
1. การหาจุดเดือด ( Boiling Point ) การที่สารไม่บริสุทธิ์ หรือ สารละลายจุดเดือดไม่คงที่ เกิดจากอัตราส่วนระหว่างจำนวนโมเลกุลของตัวถูกละลาย และ ตัวทำละลาย เปลี่ยนแปลงไปโมเลกุลที่มีจุดเดือดต่ำจะระเหยไปเร็วกว่าทำให้สารที่มีจุดเดือดสูงใน อัตราส่วนที่ มากกว่าจึงเป็นผลให้จุดเดือดสูงขึ้นเรื่อย ๆ โดยดูจากรูปที่แสดงเป็นกราฟ
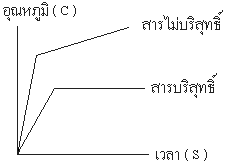
2. การหาจุดหลอมเหลว ( Melting Point ) จะสามารถทดสอบกับสารที่บริสุทธิ์ และสารที่ไม่บริสุทธิ์ได้ โดย
- สารบริสุทธิ์จะมีจุดหลอมเหลวคงที่ และ มีอุณหภูมิช่วงการหลอมเหลวแคบ
- สารไม่บริสุทธิ์จะมีจุดหลอมเหลวไม่คงที่ และ มีอุณหภูมิในช่วงการหลอมเหลวกว้างซึ่งอุณหภูมิฃ่วงการหลอม หมายถึง อุณหภูมิที่สารเริ่มต้นหลอมจนกระทั่งสารนั้นหลอมหมดโดยในอุณหภูมิช่วงการหลอม ถ้าแคบต้องไม่เกิน 2 องศาเซลเซียส โดยดูจากรูปที่แสดงเป็นกราฟ
- สารบริสุทธิ์จะมีจุดหลอมเหลวคงที่ และ มีอุณหภูมิช่วงการหลอมเหลวแคบ
- สารไม่บริสุทธิ์จะมีจุดหลอมเหลวไม่คงที่ และ มีอุณหภูมิในช่วงการหลอมเหลวกว้างซึ่งอุณหภูมิฃ่วงการหลอม หมายถึง อุณหภูมิที่สารเริ่มต้นหลอมจนกระทั่งสารนั้นหลอมหมดโดยในอุณหภูมิช่วงการหลอม ถ้าแคบต้องไม่เกิน 2 องศาเซลเซียส โดยดูจากรูปที่แสดงเป็นกราฟ
- สารไม่บริสุทธิ์จะมีจุดหลอมเหลวไม่คงที่ และ มีอุณหภูมิในช่วงการหลอมเหลวกว้างซึ่งอุณหภูมิฃ่วงการหลอม หมายถึง อุณหภูมิที่สารเริ่มต้นหลอมจนกระทั่งสารนั้นหลอมหมดโดยในอุณหภูมิช่วงการหลอม ถ้าแคบต้องไม่เกิน 2 องศาเซลเซียส โดยดูจากรูปที่แสดงเป็นกราฟ
- สารบริสุทธิ์จะมีจุดเยือกแข็งคงที่
- สารไม่บริสุทธิ์จะมีจุดเยือกแข็งไม่คงที่
- สารไม่บริสุทธิ์จะมีจุดเยือกแข็งไม่คงที่
โดยดูจากรูปที่แสดงเป็นกราฟ
การแยกสาร
ใช้ในการแยกสารประกอบซึ่งมี 7 วิธี ได้แก่
1. การกลั่น
เหมาะสำหรับแยกของเหลวที่ปนเป็นเนื้อเดียวกัน โดยทำให้ของเหลวกลายเป็นไอ แล้วทำให้ควบแน่นเป็นของเหลวอีก แบ่งออก เป็น 2 ประเภท คือ
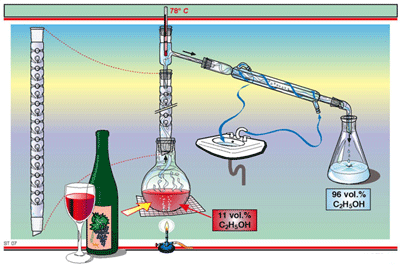
- การกลั่นธรรมดา เหมาะสำหรับสารที่มีจุดเดือดต่างกันประมาณ 80 องศาเซลเซียส ขึ้นไป แต่อุณหภูมิตั้งแต่ 40 องศาเซลเซียส
ก็จะเกิดกระบวนการแล้ว
ก็จะเกิดกระบวนการแล้ว
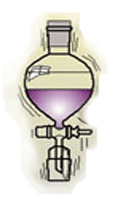
2. การใช้กรวยแยก
เหมาะสมกับสารที่เป็นของเหลว และ จะต้องเป็นสารที่ไม่ละลายต่อกัน หรือ จะต้องมีขั้วต่างกัน เช่น น้ำ และ น้ำมัน
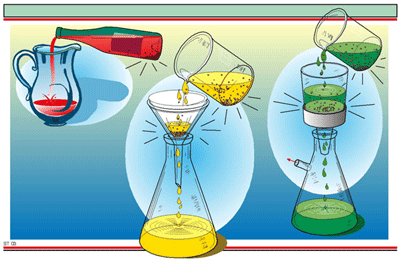
เหมาะสำหรับของแข็งที่ไม่ละลายน้ำ หรือ ของแข็งที่ละลายน้ำ และ ไม่ละลายน้ำปนอยู่ด้วยกัน เช่น หินปูน และ น้ำ
เหมาะสำหรับสารที่สามารถละลายได้เป็นปรากฏการณ์ที่ตัวถูกละลายที่เป็นของแข็ง แยกตัวออกจากสารละลายได้เป็นของแข็งที่มีรูปทรงเรขาคณิต โดยสารใด ๆ ที่ละลายในน้ำอยู่ในจุดอิ่มตัวจะตกเป็นผลึก ถ้ามากเกินพอจะเป็นการตกตะกอนของสาร
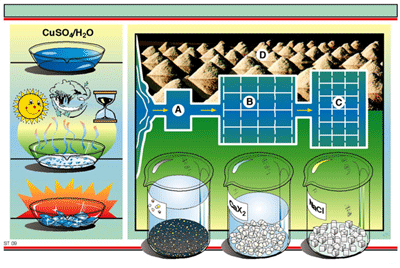
เหมาะสมสำหรับการสกัดพวกน้ำมันหอมระเหยจากพืช และ การทำน้ำหอม ( CH3COOH2O ) โดยมีหลักสำคัญ ดังนี้
- จุดเดือดต่ำจะระเหยง่าย ถ้าเป็นสารที่มีจุดเดือดสูง จะต้องการกลั่นโดยอาศัยการเปลี่ยนแปลงความดันในระบบ
- สารส่วนใหญ่ไม่ละลายน้ำ
เหมาะสมกับสารที่ระเหยง่าย โดยมีหลักสำคัญดังนี้
- ถ้าสารมีความสามารถในการละลายในตัวทำละลายต่างชนิดกันสามารถแยกสารออกจากกันได้
- หลักการเลือกตัวทำละลายที่ดี คือ ต้องเลือกตัวทำละลายที่ดี คือ ต้องเลือกตัวทำละลายที่ละลายสารที่ต่างกัน การสกัดออกมามากที่สุด และสิ่งเจือปนนั้นจะต้องติดมาน้อยที่สุด
เหมาะสมสำหรับการแยกสารที่มความสามารถในการละลาย และ ดูดซับไม่เท่ากัน , สารที่มีปริมาณน้อย และ ไม่มีสี โดยหลักสำคัญ มีดังนี้
- ในการทดลองทุกครั้งจะต้องปิดฝา เพื่อป้องกันตัวทำละลายแห้ง ในขณะที่เคลื่อนที่บนตัวดูดซับ
- ถ้าสารเคลื่อนทีใกล้เคียงกันมาก แสดงว่าสารมีความสามารถในการละลาย และ ดูดซับได้ใกล้เคียง และ จะแก้ไขได้โดย การเปลี่ยนตัวทำละลาย หรือ เพิ่มความยาวของดูดซับได้ แต่สารที่เคลื่อนที่ได้ระยะทางเท่ากันในตัวทำละลาย และ ตัวดูดซับใกล้เคียงกัน มักจะสรุปได้ว่าสารนั้นเป็นสารเดียวกัน
โดยวิธีนี้สามารถทำให้สารบริสุทธิ์ได้ โดยตัดแบ่งสารที่ต้องการละลายในตัวทำละลายที่เหมาะสม แล้วระเหยตัวทำละลายนั้นทิ้งไป แล้วนำสารนั้นมาทำการโครมาโทรกราฟีใหม่ จนได้สารบริสุทธิ์
2. การใช้เนื้อสารเป็นเกณฑ์ จะมีสมบัติทางกายภาพของสารที่ได้จากการสังเกตลักษณะความแตกต่างของเนื้อสาร ซึ่งจะจำแนกได้ออกเป็น 2 กลุ่ม คือ
จะสามารถจำแนกออกเป็น 4 กรณี ได้แก่ 1. การใช้สถานะเป็นเกณฑ์ แบ่งออกเป็น 3 กลุ่ม คือ
- สถานะที่เป็นของแข็ง ( Solid ) จะมีรูปร่าง และ ปริมาตรคงที่ ซึ่งอนุภาคภายในจะอยู่ชิดติดกัน เช่น ด่างทับทิม ( KMnO4 ) , ทองแดง ( Cu )
- สถานะที่เป็นของเหลว ( Liquid ) จะมีรูปร่างตามภาชนะที่บรรจุ และ มีปริมาตรที่คงที่ ซึ่งอนุภาคภายในจะอยู่ชิดกันน้อยกว่าของแข็ง และ มีสมบัติเป็นของไหล เช่น น้ำมัน , แอลกอฮอล์ , ปรอท ( Hg ) ฯลฯ
- สถานะที่เป็นก๊าซ ( Gas ) จะมีรูปร่าง และ ปริมาตรที่ไม่คงที่ โดยรูปร่าง จะเปลี่ยนไปตามภาชนะที่บรรจุ อนุภาคภายในจะอยู่ ห่างกันมากที่สุด และ มีสมบัติเป็นของไหลได้ เช่น ก๊าซหุงต้ม , อากาศ
- สถานะที่เป็นของแข็ง ( Solid ) จะมีรูปร่าง และ ปริมาตรคงที่ ซึ่งอนุภาคภายในจะอยู่ชิดติดกัน เช่น ด่างทับทิม ( KMnO4 ) , ทองแดง ( Cu ) - สถานะที่เป็นของเหลว ( Liquid ) จะมีรูปร่างตามภาชนะที่บรรจุ และ มีปริมาตรที่คงที่ ซึ่งอนุภาคภายในจะอยู่ชิดกันน้อยกว่าของแข็ง และ มีสมบัติเป็นของไหล เช่น น้ำมัน , แอลกอฮอล์ , ปรอท ( Hg ) ฯลฯ - สถานะที่เป็นก๊าซ ( Gas ) จะมีรูปร่าง และ ปริมาตรที่ไม่คงที่ โดยรูปร่าง จะเปลี่ยนไปตามภาชนะที่บรรจุ อนุภาคภายในจะอยู่ ห่างกันมากที่สุด และ มีสมบัติเป็นของไหลได้ เช่น ก๊าซหุงต้ม , อากาศ
- สารเนื้อเดียว ( Homogeneous Substance ) หมายถึง สารที่มีเนื้อสารเหมือนกันทุกส่วน ทำให้สารมีสมบัติเหมือนกันตลอดทุกส่วน เช่น แอลกอฮอล์ , ทองคำ ( Au ) , โลหะบัดกรี- สถานะที่เป็นของแข็ง ( Solid ) จะมีรูปร่าง และ ปริมาตรคงที่ ซึ่งอนุภาคภายในจะอยู่ชิดติดกัน เช่น ด่างทับทิม ( KMnO4 ) , ทองแดง ( Cu )
- สถานะที่เป็นของเหลว ( Liquid ) จะมีรูปร่างตามภาชนะที่บรรจุ และ มีปริมาตรที่คงที่ ซึ่งอนุภาคภายในจะอยู่ชิดกันน้อยกว่าของแข็ง และ มีสมบัติเป็นของไหล เช่น น้ำมัน , แอลกอฮอล์ , ปรอท ( Hg ) ฯลฯ
- สถานะที่เป็นก๊าซ ( Gas ) จะมีรูปร่าง และ ปริมาตรที่ไม่คงที่ โดยรูปร่าง จะเปลี่ยนไปตามภาชนะที่บรรจุ อนุภาคภายในจะอยู่ ห่างกันมากที่สุด และ มีสมบัติเป็นของไหลได้ เช่น ก๊าซหุงต้ม , อากาศ
- สถานะที่เป็นของแข็ง ( Solid ) จะมีรูปร่าง และ ปริมาตรคงที่ ซึ่งอนุภาคภายในจะอยู่ชิดติดกัน เช่น ด่างทับทิม ( KMnO4 ) , ทองแดง ( Cu ) - สถานะที่เป็นของเหลว ( Liquid ) จะมีรูปร่างตามภาชนะที่บรรจุ และ มีปริมาตรที่คงที่ ซึ่งอนุภาคภายในจะอยู่ชิดกันน้อยกว่าของแข็ง และ มีสมบัติเป็นของไหล เช่น น้ำมัน , แอลกอฮอล์ , ปรอท ( Hg ) ฯลฯ - สถานะที่เป็นก๊าซ ( Gas ) จะมีรูปร่าง และ ปริมาตรที่ไม่คงที่ โดยรูปร่าง จะเปลี่ยนไปตามภาชนะที่บรรจุ อนุภาคภายในจะอยู่ ห่างกันมากที่สุด และ มีสมบัติเป็นของไหลได้ เช่น ก๊าซหุงต้ม , อากาศ
- สารเนื้อผสม ( Heterogeneous Substance ) หมายถึง สารที่มีเนื้อสารแตกต่างกันในแต่ละส่วน จะทำให้สารนั้นมีสมบัติ ไม่เหมือนกันตลอดทุกส่วน เช่น น้ำอบไทย , น้ำคลอง ฯลฯ
3. การละลายน้ำเป็นเกณฑ์ จะจำแนกได้ออกเป็น 3 กลุ่ม คือ
- สารที่ละลายน้ำได้ เช่น เกลือแกง ( NaCl ) , ด่างทับทิม ( KMnO4 ) ฯลฯ
- สารที่ละลายน้ำได้บ้าง เช่น ก๊าซคลอรีน ( Cl2 ) , ก๊าซคาร์บอนไดออกไซด์ ( CO2 ) ฯลฯ
- สารที่ไม่สามารถละลายน้ำได้ เช่น กำมะถัน ( S8 ) , เหล็ก ( Fe ) ฯลฯ
- สารที่ละลายน้ำได้ เช่น เกลือแกง ( NaCl ) , ด่างทับทิม ( KMnO4 ) ฯลฯ
- สารที่ละลายน้ำได้บ้าง เช่น ก๊าซคลอรีน ( Cl2 ) , ก๊าซคาร์บอนไดออกไซด์ ( CO2 ) ฯลฯ
- สารที่ไม่สามารถละลายน้ำได้ เช่น กำมะถัน ( S8 ) , เหล็ก ( Fe ) ฯลฯ
4. การนำไฟฟ้าเป็นเกณฑ์ จะจำแนกได้ออกเป็น 2 กลุ่ม ได้แก่
- สารที่นำไฟฟ้าได้ เช่น ทองแดง ( Cu ) , น้ำเกลือ ฯลฯ
- สารที่ไม่นำไฟฟ้า เช่น หินปูน ( CaCO3 ) , ก๊าซออกซิเจน ( O2 )
แต่โดยส่วนใหญ่นักเคมี จะแบ่งสารตามลักษณะเนื้อสารเป็นเกณฑ์ ดังนี้
- สารที่นำไฟฟ้าได้ เช่น ทองแดง ( Cu ) , น้ำเกลือ ฯลฯ
- สารที่ไม่นำไฟฟ้า เช่น หินปูน ( CaCO3 ) , ก๊าซออกซิเจน ( O2 )
แต่โดยส่วนใหญ่นักเคมี จะแบ่งสารตามลักษณะเนื้อสารเป็นเกณฑ์ ดังนี้
สารบริสุทธิ์ ( Pure Substance ) คือ สารเนื้อเดียวที่มีจุดเดือด และ จุดหลอมเหลวคงที่
ธาตุ ( Element ) คือ สารบริสุทธิ์ที่ประกอบด้วยอะตอมเพียงชนิดเดียวกัน เช่น คาร์บอน ( C ) , กำมะถัน ( S8 )
สารประกอบ ( Compound Substance ) เกิดจากธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมกัน โดยมีอัตราส่วนในการร่วมกันคงที่แน่นอนได้แก่ กรดน้ำส้ม ( CH3COOH ) , กรดไฮโดรคลอริก ( HCl ) ฯลฯ
ของผสม ( Mixture ) หมายถึง สารที่เกิดจากการนำสารตั้งแต่ 2 ชนิดขึ้นไปมาผสมกันโดยไม่จำกัดส่วนผสม และ ในการผสมกัน
นั้นไม่มีปฏิกิริยาเกิดขึ้นระหว่างสารองค์ประกอบที่นำมาผสมกัน ซึ่งมี 3 ประเภท ได้แก่
นั้นไม่มีปฏิกิริยาเกิดขึ้นระหว่างสารองค์ประกอบที่นำมาผสมกัน ซึ่งมี 3 ประเภท ได้แก่
1. สารละลาย ( Solution Substance ) เป็นสารเนื้อเดียวที่มีสัดส่วนในการรวมกันของธาตุ หรือ สารประกอบไม่คงที่ไม่สามารถเขียนสูตรได้อย่างแน่นอน และ มีขนาดอนุภาคที่เล็กกว่า 10-7 เซนติเมตร ซึ่งมี 3 สถานะ เช่น อากาศ , น้ำอัดลม , นาก , และ โลหะผสม ทุกชนิด ฯลฯ ซึ่งสารละลายจะแบ่งออกเป็น 2 ส่วน ได้แก่ ตัวทำละลาย ( Solvent ) และ ตัวถูกละลาย ( Solute ) จะมีข้อสังเกต ดังนี้
- สารใดที่มีปริมาณมากจะเป็นตัวทำละลาย และ สารใดมีปริมาณน้อยจะเป็นตัวถูกละลาย เช่น
แอลกอฮอล์ฆ่าเชื้อ มีเอทานอล 70 % และ น้ำ ( H2O ) 30 % หมายความว่า น้ำจะเป็นตัวถูกละลาย และ เอทานอลเป็นสารละลาย เพราะแอลกอฮอล์มีปริมาณตามเปอร์เซนต์ที่มากกว่าน้ำ
- สารใดที่มีสถานะเช่นเดียวกับสารละลายเป็นตัวทำละลาย เช่น
น้ำเชื่อม ซึ่งน้ำเชื่อมจัดอยู่ในสภาพที่เป็นของเหลว ( Liquid ) ดังนั้นจึงสรุปได้ว่า น้ำเป็นตัวทำละลาย และ น้ำตาลทราย ( C12H22O11 ) เป็นตัวถูกละลาย
- สารใดที่มีปริมาณมากจะเป็นตัวทำละลาย และ สารใดมีปริมาณน้อยจะเป็นตัวถูกละลาย เช่น
แอลกอฮอล์ฆ่าเชื้อ มีเอทานอล 70 % และ น้ำ ( H2O ) 30 % หมายความว่า น้ำจะเป็นตัวถูกละลาย และ เอทานอลเป็นสารละลาย เพราะแอลกอฮอล์มีปริมาณตามเปอร์เซนต์ที่มากกว่าน้ำ
- สารใดที่มีสถานะเช่นเดียวกับสารละลายเป็นตัวทำละลาย เช่น
น้ำเชื่อม ซึ่งน้ำเชื่อมจัดอยู่ในสภาพที่เป็นของเหลว ( Liquid ) ดังนั้นจึงสรุปได้ว่า น้ำเป็นตัวทำละลาย และ น้ำตาลทราย ( C12H22O11 ) เป็นตัวถูกละลาย
2. สารแขวนลอย ( Suspension Substance ) คือ สารที่เกิดจากอนุภาคขนาดเส้นผ่าศูนย์กลางที่มากกว่า 10-4 เซนติเมตร ซึ่งจะลอยกระจายอยู่ในตัวกลางโดยอนุภาคที่มีอยู่ในของผสมนั้นมีขนาดใหญ่ จึงสามารถมองเห็นอนุภาคในของผสมได้อย่างชัดเจน เมื่อตั้งทิ้งไว้ อนุภาคจะตกตะกอนลงมา ซึ่งสารแขวนลอยนั้นจะไม่สามารถผ่านได้ทั้งกระดาษกรอง และ กระดาษเซลโลเฟน เช่น โคลน , น้ำอบไทย
3. คอลลอยด์ ( Colliod ) จะประกอบด้วยอนุภาคขนาดเส้นผ่าศูนย์กลางระหว่าง 10-4 และ 10-7 เซนติเมตร ซึ่งจะไม่มีการตกตะกอน สามารถกระเจิงแสงได้ ซึ่งเรียกปรากฏการณ์นี้ว่า " ปรากฏการณ์ทินดอลล์ " และ ภายในอนุภาคก็มีการเคลื่อนที่แบบบราวน์เนียน( Brownian Movement ) กล่าวคือ เป็นการเคลื่อนที่ที่ไม่แน่นอน ในแนวเส้นตรง ซึ่งจะสามารถส่องดูได้จากเครื่องที่เรียกว่า " อัลตราไมโครสโคป " ( Ultramicroscope ) ซึ่งคอลลอยด์จะสามารถผ่านกระดาษกรองได้ แต่ไม่สามารถผ่านกระดาษเซลโลเฟนได้ เช่น กาว , นมสด
คอลลอยด์ในชีวิตประจำวัน
คอลลอยด์มีหลายชนิด ดังนี้
ประเภทของคอลลอยด์
|
สถานะของอนุภาค
|
สถานะของตัวกลาง
|
ตัวอย่าง
|
แอโรซอล
|
ของเหลว
|
ก๊าซ
|
เมฆ , สเปรย์ , หมอก
|
แอโรซอล
|
ของแข็ง
|
ก๊าซ
|
ควันไฟ , ฝุ่น
|
อิมัลชัน
|
ของเหลว
|
ของเหลว
|
นมสด , น้ำกะทิ , สลัด
|
เจล
|
ของแข็ง
|
ของเหลว
|
เยลลี่ , วุ้น , กาว , ยาสีฟัน
|
โฟม
|
ก๊าซ
|
ของเหลว
|
ฟองสบู่ , ครีมโกนหนวด
|
โฟม
|
ก๊าซ
|
ของแข็ง
|
เม็ดโฟม , สบู่ก้อน
|
มี 3 ประเภท ได้แก่
1. การหาจุดเดือด ( Boiling Point ) การที่สารไม่บริสุทธิ์ หรือ สารละลายจุดเดือดไม่คงที่ เกิดจากอัตราส่วนระหว่างจำนวนโมเลกุลของตัวถูกละลาย และ ตัวทำละลาย เปลี่ยนแปลงไปโมเลกุลที่มีจุดเดือดต่ำจะระเหยไปเร็วกว่าทำให้สารที่มีจุดเดือดสูงใน อัตราส่วนที่ มากกว่าจึงเป็นผลให้จุดเดือดสูงขึ้นเรื่อย ๆ โดยดูจากรูปที่แสดงเป็นกราฟ

2. การหาจุดหลอมเหลว ( Melting Point ) จะสามารถทดสอบกับสารที่บริสุทธิ์ และสารที่ไม่บริสุทธิ์ได้ โดย
- สารบริสุทธิ์จะมีจุดหลอมเหลวคงที่ และ มีอุณหภูมิช่วงการหลอมเหลวแคบ
- สารไม่บริสุทธิ์จะมีจุดหลอมเหลวไม่คงที่ และ มีอุณหภูมิในช่วงการหลอมเหลวกว้างซึ่งอุณหภูมิฃ่วงการหลอม หมายถึง อุณหภูมิที่สารเริ่มต้นหลอมจนกระทั่งสารนั้นหลอมหมดโดยในอุณหภูมิช่วงการหลอม ถ้าแคบต้องไม่เกิน 2 องศาเซลเซียส โดยดูจากรูปที่แสดงเป็นกราฟ
- สารบริสุทธิ์จะมีจุดหลอมเหลวคงที่ และ มีอุณหภูมิช่วงการหลอมเหลวแคบ
- สารไม่บริสุทธิ์จะมีจุดหลอมเหลวไม่คงที่ และ มีอุณหภูมิในช่วงการหลอมเหลวกว้างซึ่งอุณหภูมิฃ่วงการหลอม หมายถึง อุณหภูมิที่สารเริ่มต้นหลอมจนกระทั่งสารนั้นหลอมหมดโดยในอุณหภูมิช่วงการหลอม ถ้าแคบต้องไม่เกิน 2 องศาเซลเซียส โดยดูจากรูปที่แสดงเป็นกราฟ
- สารไม่บริสุทธิ์จะมีจุดหลอมเหลวไม่คงที่ และ มีอุณหภูมิในช่วงการหลอมเหลวกว้างซึ่งอุณหภูมิฃ่วงการหลอม หมายถึง อุณหภูมิที่สารเริ่มต้นหลอมจนกระทั่งสารนั้นหลอมหมดโดยในอุณหภูมิช่วงการหลอม ถ้าแคบต้องไม่เกิน 2 องศาเซลเซียส โดยดูจากรูปที่แสดงเป็นกราฟ
- สารบริสุทธิ์จะมีจุดเยือกแข็งคงที่
- สารไม่บริสุทธิ์จะมีจุดเยือกแข็งไม่คงที่
- สารไม่บริสุทธิ์จะมีจุดเยือกแข็งไม่คงที่
โดยดูจากรูปที่แสดงเป็นกราฟ
การแยกสาร
ใช้ในการแยกสารประกอบซึ่งมี 7 วิธี ได้แก่
1. การกลั่น
เหมาะสำหรับแยกของเหลวที่ปนเป็นเนื้อเดียวกัน โดยทำให้ของเหลวกลายเป็นไอ แล้วทำให้ควบแน่นเป็นของเหลวอีก แบ่งออก เป็น 2 ประเภท คือ
- การกลั่นธรรมดา เหมาะสำหรับสารที่มีจุดเดือดต่างกันประมาณ 80 องศาเซลเซียส ขึ้นไป แต่อุณหภูมิตั้งแต่ 40 องศาเซลเซียส
ก็จะเกิดกระบวนการแล้ว
ก็จะเกิดกระบวนการแล้ว
2. การใช้กรวยแยก
เหมาะสมกับสารที่เป็นของเหลว และ จะต้องเป็นสารที่ไม่ละลายต่อกัน หรือ จะต้องมีขั้วต่างกัน เช่น น้ำ และ น้ำมัน

เหมาะสำหรับของแข็งที่ไม่ละลายน้ำ หรือ ของแข็งที่ละลายน้ำ และ ไม่ละลายน้ำปนอยู่ด้วยกัน เช่น หินปูน และ น้ำ
เหมาะสำหรับสารที่สามารถละลายได้เป็นปรากฏการณ์ที่ตัวถูกละลายที่เป็นของแข็ง แยกตัวออกจากสารละลายได้เป็นของแข็งที่มีรูปทรงเรขาคณิต โดยสารใด ๆ ที่ละลายในน้ำอยู่ในจุดอิ่มตัวจะตกเป็นผลึก ถ้ามากเกินพอจะเป็นการตกตะกอนของสาร

เหมาะสมสำหรับการสกัดพวกน้ำมันหอมระเหยจากพืช และ การทำน้ำหอม ( CH3COOH2O ) โดยมีหลักสำคัญ ดังนี้
- จุดเดือดต่ำจะระเหยง่าย ถ้าเป็นสารที่มีจุดเดือดสูง จะต้องการกลั่นโดยอาศัยการเปลี่ยนแปลงความดันในระบบ
- สารส่วนใหญ่ไม่ละลายน้ำ
เหมาะสมกับสารที่ระเหยง่าย โดยมีหลักสำคัญดังนี้
- ถ้าสารมีความสามารถในการละลายในตัวทำละลายต่างชนิดกันสามารถแยกสารออกจากกันได้
- หลักการเลือกตัวทำละลายที่ดี คือ ต้องเลือกตัวทำละลายที่ดี คือ ต้องเลือกตัวทำละลายที่ละลายสารที่ต่างกัน การสกัดออกมามากที่สุด และสิ่งเจือปนนั้นจะต้องติดมาน้อยที่สุด
เหมาะสมสำหรับการแยกสารที่มความสามารถในการละลาย และ ดูดซับไม่เท่ากัน , สารที่มีปริมาณน้อย และ ไม่มีสี โดยหลักสำคัญ มีดังนี้
- ในการทดลองทุกครั้งจะต้องปิดฝา เพื่อป้องกันตัวทำละลายแห้ง ในขณะที่เคลื่อนที่บนตัวดูดซับ
- ถ้าสารเคลื่อนทีใกล้เคียงกันมาก แสดงว่าสารมีความสามารถในการละลาย และ ดูดซับได้ใกล้เคียง และ จะแก้ไขได้โดย การเปลี่ยนตัวทำละลาย หรือ เพิ่มความยาวของดูดซับได้ แต่สารที่เคลื่อนที่ได้ระยะทางเท่ากันในตัวทำละลาย และ ตัวดูดซับใกล้เคียงกัน มักจะสรุปได้ว่าสารนั้นเป็นสารเดียวกัน
โดยวิธีนี้สามารถทำให้สารบริสุทธิ์ได้ โดยตัดแบ่งสารที่ต้องการละลายในตัวทำละลายที่เหมาะสม แล้วระเหยตัวทำละลายนั้นทิ้งไป แล้วนำสารนั้นมาทำการโครมาโทรกราฟีใหม่ จนได้สารบริสุทธิ์
2. การใช้เนื้อสารเป็นเกณฑ์ จะมีสมบัติทางกายภาพของสารที่ได้จากการสังเกตลักษณะความแตกต่างของเนื้อสาร ซึ่งจะจำแนกได้ออกเป็น 2 กลุ่ม คือ
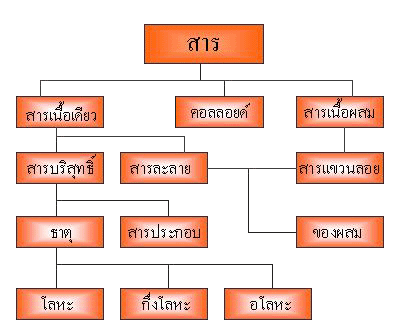
คอลลอยด์ที่พบในชีวิตประจำวัน คือ อิมัลชัน ( Emulsion ) โดยอิมัลชัน คือ คอลลอยด์ที่เกิดระหว่างของเหลว กับของเหลว ซึ่ง สามารถปนเป็นเนื้อเดียวกันได้โดยมีอิมัลซิฟายเออร์ ( Emulsifier ) เป็นตัวประสาน เช่น น้ำ + น้ำมัน ( ไม่สามารถรวมตัวกันได้ ) ดังนั้น น้ำสบู่จึงเป็นอิมัลซิฟายเออร์เป็นตัวประสานจึงสามารถรวมตัวกันได้
3. การหาจุดเยือกแข็ง ( Freezing Point ) จะสามารถทดสอบกับสารบริสุทธิ์ และ สารไม่บริสุทธิ์ ซึ่งไม่ค่อยนิยม เพราะจะต้อง ใช้เวลานานมากในการหาจุดเยือกแข็ง โดย

- การกลั่นลำดับส่วน เหมาะสำหรับสารที่มีจุดเดือดต่างกันเพียงเล็กน้อย ซึ่งจะมีข้อเสีย คือ จะใช้พลังงานเป็นจำนวนมาก และมีความสลับซับซ้อน การกลั่นลำดับส่วนบางครั้งไม่ได้แยกสารให้บริสุทธิ์ แต่แยกเพื่อประโยชน์ในการนำไปใช้ เช่น การแยกน้ำมันดิบ โดยจะแยกพวกที่มีจุดเดือดใกล้เคียงไว้ด้วยกัน แต่ถ้าสารที่มีจุดเดือดใกล้เคียงกันมาก แต่ไม่มีเครื่องกลั่นลำดับส่วนก็สามารถกลั่นได้ด้วยเครื่องกลั่นธรรมดา แต่จะต้องกลั่นหลาย ๆ ครั้ง จนกระทั่งจุดเดือด และจุดหลอมเหลวคงที่
3. การกรอง
4. การตกผลึก
5. การสกัดด้วยไอน้ำ
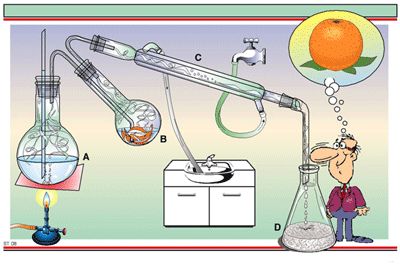
6. การสกัดด้วยตัวทำละลาย
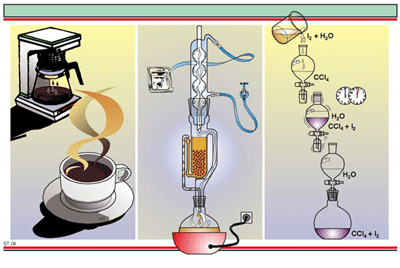
7. การโครมาโทรกราฟี
ไม่มีความคิดเห็น:
แสดงความคิดเห็น